Buenos Aires, 30 de noviembre de 2016 – Desde la Federación Argentina de Enfermedades Poco Frecuentes (FADEPOF), y basados en el contexto actual de la Honorable Cámara de Diputados de la Nación que tiene en la Comisión de Acción Social y Salud Pública el proyecto 0770-D-2016 de reforma de la Ley 25.649 de “Prescripción por nombre genérico”, la institución cree oportuno, que dicha reforma pueda abordar lo que el avance de la ciencia, tecnología e innovación ha producido en lo referido a medicamentos.
Desde la Federación Argentina de Enfermedades Poco Frecuentes (FADEPOF), han realizado un manifiesto con el fin de evidenciar la necesidad de clarificar las distintas clasificaciones de medicamentos, que, a partir de los notables avances producidos en el ámbito de la ciencia, tecnología e innovación vinculada a la salud, nos sitúa hoy frente a una revolución en términos de medicamentos.
A su vez, manifiestan la oportunidad de que la normativa actual (Ley 25.649) reconozca las diferentes clasificaciones. Y especifique que en el caso de fármacos más complejos y biotecnológicos, su prescripción deba incluir tanto el principio activo como la denominación comercial, para garantizar la rápida y clara identificación del producto en cuestión ante un posible efecto adverso o problema de calidad.
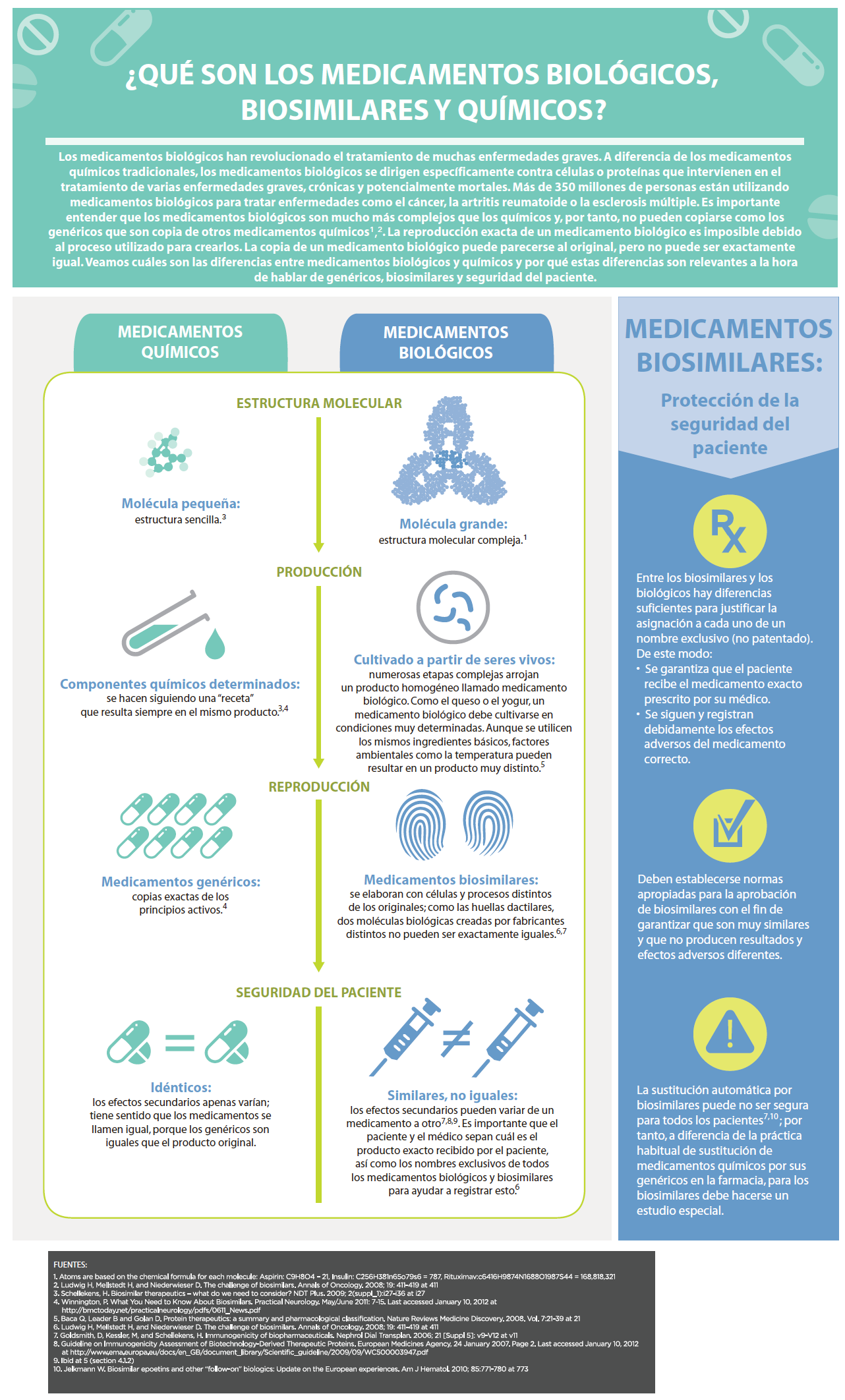
La escasa información en “lenguaje no técnico” estaría dando lugar a errores de comprensión entre los consumidores, relacionados con las amplias diferencias de estructuras, complejidad y procesos de elaboración entre los medicamentos de síntesis química/ tradicionales, los más complejos y los medicamentos biotecnológicos, provocando consecuencias en la seguridad del paciente y, por ende, su salud.
Los pacientes demandan hacer uso del derecho a estar informados y participar de modo consciente y fundado de la toma de decisión sobre cuál es el mejor tratamiento disponible para su condición de salud en consenso con el médico tratante, promoviendo como principio rector que los esfuerzos de las demás partes involucradas responsables garanticen la calidad, seguridad y eficacia de los medicamentos en pos de la máxima “Seguridad del paciente”.
Si bien, sería necesario una normativa específica que regule la prescripción, dispensación y administración de los Biotecnológicos (biológicos innovadores y biosimilares) y los medicamentos de síntesis química bajo la denominación de genérico.
Y destacan la necesidad de fomentar los reportes al Sistema Nacional de Farmacovigilancia sobre reacciones adversas, ineficacia terapéutica y/o eventos no esperados de los medicamentos que favorecerán la “Seguridad del Paciente”.
Los medicamentos de síntesis química/ tradicionales son de estructura pequeña y simple elaborados a partir de la combinación de ingredientes químicos fáciles de reproducir y estables.
Los medicamentos biotecnológicos se producen a partir de microorganismos vivos mediante procesos de ingeniería genética, de grandes estructuras complejas Muchos de éstos medicamentos han cambiado el rumbo de enfermedades crónicas, complejas, enfermedades poco frecuentes, como así también, de otras enfermedades de mayor prevalencia que tiempo atrás se consideraban sin opción terapéutica, con pronósticos desalentadores, e incluso, enfermedades para las cuales existían pocos medicamentos exitosos.
En estos casos, es vital que el paciente comprenda las diferencias, pero también que el marco legal lo proteja sabiendo que las cuestiones clínicas y científicas excederán sus competencias, enfatizan desde FADEPOF.
La sustitución en el momento de la dispensación de los medicamentos de síntesis tradicionales no reviste ningún riesgo para el paciente. Sin embargo, la sustitución –sin autorización del médico prescriptor-, de medicamentos de síntesis química complejos o biotecnológicos podría echar por tierra los esfuerzos, que el propio paciente paga con su salud, para lograr la estabilidad y eficacia terapéutica del tratamiento. Poniendo en juego innecesariamente la seguridad del paciente, ignorando también el rol fundamental de la trazabilidad y la farmacovigilancia.
La reforma del marco legal debe reflejar el aprendizaje que el paso del tiempo ha dejado y que la evidencia científica ha observado en lo referente a los errores de medicación, que incluyen la prescripción (responsabilidad del médico tratante), la dispensación (a cargo del farmacéutico y/o entidades de la Seguridad Social), la administración (a cargo del propio paciente y/o cuidador) y el cumplimiento terapéutico -lo que se conoce como adherencia al tratamiento- (por parte del paciente).
“Debemos asumir que el aumento de la oferta y acceso a nuevas terapias por parte de los pacientes modifica el escenario del conocimiento que hasta años atrás se preservaba bajo el modelo médico hegemónico. Los pacientes demandamos hacer uso del derecho a estar informados y participar de modo consciente y fundado de la toma de decisión sobre cuál es el mejor tratamiento disponible para nuestra condición de salud en consenso con el médico tratante, dando por descontado que todas las partes involucradas responsables garanticen la calidad, seguridad y eficacia de los medicamentos en pos de la máxima ‘Seguridad del paciente’ como principio rector”, sostuvo Inés Castellano, presidente de FADEPOF.
En opinión del Prof. Dr. Christian Höcht, farmacéutico, Profesor Asociado de la Cátedra de Farmacología de la Facultad de Farmacia y Bioquímica de la UBA, “la autoridad de aplicación no requiere de determinaciones de bioequivalencia mediante estudios clínicos (con definida estructura y dedicación) en la mayoría de los medicamentos de síntesis química, como ser un analgésico liviano o un antitusivo”. Sólo los exige en un pequeño número de moléculas denominadas “de riesgo sanitario” destinadas para “el tratamiento de condiciones algo más complejas. En el mercado argentino se comercializa una gran cantidad de medicamentos copia (similares) que no son bioequivalentes a los originales.”
La biodisponibilidad es un parámetro que indica la cantidad de fármaco en la sangre de un paciente luego de la toma de un medicamento. Por su parte, la bioequivalencia evalúa si los ingredientes activos de un medicamento que aspira a ser genérico, se absorben de la misma manera y tiempos que el producto original, aportando una biodisponibilidad similar.
“Los pacientes y las organizaciones que los representan, deben comprender la importancia de la farmacovigilancia en la prevención o reducción de posibles efectos nocivos para el propio paciente, siendo fundamental el compromiso de realizar los reportes de reacciones adversas, ineficacia terapéutica y/o eventos no esperados al Sistema Nacional de Farmacovigilancia de ANMAT, que tiene el objetivo de evaluar y controlar el nivel de seguridad que ofrece el uso de los medicamentos.
La autoridad sanitaria convoca a los profesionales de la salud, a los representantes de la industria farmacéutica y a los propios pacientes o sus familiares a reportar notificaciones ante reacciones adversas y sospechas de fallas de calidad, que pueden realizarse online (www.anmat.gov.ar/farmacovigilancia) o por vía telefónica al 0800-333-1234. Aquí la importancia que frente al uso de medicamentos complejos o biotecnológicos la prescripción incluya tanto el principio activo como su denominación comercial para la rápida identificación del fármaco en cuestión, situación que no sería posible ante la sustitución automática de los medicamentos al momento de la dispensación”, completó la Lic. Luciana Escati Peñaloza, Directora Ejecutiva de FADEPOF.
Medicamentos Biotecnológicos: cuando el producto es el proceso
Otra de las preocupaciones manifestadas por la entidad consistió en que, en muchos casos, sólo se pone el foco casi exclusivamente en la reducción de costos sin priorizar el debido análisis de los criterios establecidos por la Organización Mundial de la Salud (OMS), que especifica claramente que a los medicamentos biotecnológicos -más precisamente los biosimilares- no es posible aplicarles los mismos criterios que a los genéricos a la hora de demostrar similitud, intercambiabilidad, sustitución y extrapolación de las indicaciones. Sino que requieren de un largo camino que lo defina y determine técnicamente mediante estudios clínicos comparativos rigurosos, en todos los estadios y para cada una de las enfermedades para los que fueran aprobados.
Los medicamentos biotecnológicos están diseñados en base a procesos biotecnológicos con tecnología recombinante, que incluye la producción de principios activos con células vivas. Entre sus características, suelen presentar una gran variabilidad, heterogeneidad e inestabilidad físico-química y pueden contener cantidades mínimas de impurezas que no deben superar ciertos valores permitidos, ya que podrían conllevar un riesgo potencial de inmunogenicidad (que es una reacción del organismo que puede afectar tanto la eficacia como la seguridad del medicamento). Todo esto hace que el proceso de elaboración sea muy sofisticado y que se presenten frecuentemente diferencias entre los biológicos originales y los biosimilares.
El resultado final de su proceso de elaboración es altamente dependiente de la precisión en los procedimientos empleados durante su desarrollo. Es por eso que suele decirse que en los medicamentos biotecnológicos ‘el producto es el proceso’. Son parte de la evolución de la medicina moderna que han demostrado, bajo evidencia científica, que proporcionan nuevas posibilidades tanto en la prevención, cura o tratamiento de ciertas enfermedades, como por ejemplo: cáncer, diabetes, esclerosis múltiple, ataques cardíacos, accidentes cerebrovasculares, enfermedades autoinmunes y varias enfermedades poco frecuentes.
“Las principales agencias sanitarias del mundo están regulando la aprobación de los medicamentos biosimilares con el requisito de estudios clínicos comparativos con el medicamento de referencia. Estas investigaciones consisten en un seguimiento de un grupo de pacientes durante un período de tiempo determinado para conocer los parámetros de seguridad y eficacia en relación con la terapia estándar o con un placebo”, precisó el Dr. Höcht. Sin embargo, en nuestro medio, algunos biosimilares han sido aprobados sólo tras presentar documentación referida a su aparente similitud con la molécula original, sin ninguna investigación que respalde tal afirmación.
Perspectiva Legal desde el “acceso al medicamento como bien social”.
A su turno, la Dra. María Inés Bianco, abogada especialista en Salud y Discapacidad, afirmó que el proyecto que motiva esta presentación, resulta importante para profundizar en el tema de acceso efectivo de la población en lo que respecta al “medicamento considerado como un bien social” y donde el tema de la “prescripción por nombre genérico” reviste importancia como una de las varias estrategias claves para el uso racional de los medicamentos. Pero esta normativa, requiere de un estudio detenido que va más allá del tema, no menos importante, del “alto costo de los tratamientos“. Precisa un análisis científico de las distintas clasificaciones de medicamentos (biológicos, biosimilares, sintéticos o tradicionales), las posibilidades ciertas de su intercambiabilidad, si cuentan con los ensayos clínicos comparativos en personas, porque tienen implicancia directa en el bien jurídico por excelencia que es el “derecho a la salud, como parte del derecho a la vida“.
La Ley 25.649 vigente, de “prescripción por nombre genérico” si bien es plausible de ser modificada y /o complementada con base en un sustento técnico de consideración, para que no se afecte el derecho del paciente al acceso efectivo al medicamento que realmente precisa, y que fuera prescripto por el médico tratante, presenta una salvaguardia precaria en la “justificación por marca” de la prescripción.
En base a esta herramienta, se puede suplir en forma primaria la ausencia legal de las consideraciones científicas y las consecuencias de la intercambiabilidad de los medicamentos, la falta de estudios comparativos entre los medicamentos biosimilares. ¨Pero tampoco alcanza, no sólo para la seguridad de los tratamientos prescriptos, sino como para una verdadera política de “precios de medicamentos“.
Deberían contemplarse no sólo los requisitos técnicos farmacológicos, estudios comparativos entre los medicamentos, sino también las pautas para la determinación de los costos de los biosimilares. No es suficiente modificar “solo el tema de la prescripción de medicamentos genéricos, sino cuenta con un sustento científico que garantice la seguridad, eficacia y calidad de los medicamentos, así como la relación de dicha norma con una política general de medicamento.
El tema es sumamente delicado, existiendo implicancias bioéticas entre el concepto de justicia en el acceso al tratamiento, requiriendo que esta iniciativa legislativa contemple en forma profunda y responsable un tema tan importante como el relacionado al “acceso al medicamento“ sostuvo la especialistas asesora de FADEPOF.
“Desde FAFEPOF deseamos contribuir desde nuestra perspectiva pacientes, por lo que hemos desarrollado un documento de posicionamiento sobre el proyecto 0770-D-2016 de la HCDN sobre la Ley 25.649 donde se realizan propuestas concretas que ayudarían a diferenciar las distintas clasificaciones de medicamentos. Los de síntesis química (originales, copias o similares, y los que poseen estudios de bioequivalencia y biodisponibilidad que evidencien su equivalente efecto terapéutico, que son los genéricos. Considerando que ciertas moléculas de síntesis son más complejas). Y los medicamentos biotecnológicos (que incluyen a los biológicos originales, los biosimilares y los intentos de copia). Ante esta amplia clasificación de medicamentos, es preciso una adecuada identificación de cada tipo de fármaco, puesto que sería conveniente que se exprese claramente con un rótulo en el packaging del producto, para que el paciente no tenga dudas con qué medicamento está llevando adelante su tratamiento, e incluso, pueda estar seguro ante la posibilidad de sustitución del medicamento prescripto por el médico tratante”, concluyó Inés Castellano.
Acerca de FADEPOF
La Federación Argentina de Enfermedades Poco Frecuentes (FADEPOF) es una Organización de la Sociedad Civil (OSC) sin fines de lucro. Surge como espacio de trabajo en junio de 2011 y fue constituida formalmente en diciembre de 2013. Actualmente, cuenta con la participación de 59 miembros entre organizaciones y grupos de pacientes y/o familiares de diversas enfermedades poco frecuentes (EPOF). Trabaja a nivel nacional y en alianzas regionales y mundiales, representando y apoyando a las comunidades de personas –y entorno familiar y social-.
FADEPOF es miembro fundador de la Alianza Iberoamericana de Enfermedades Raras (ALIBER) y de la Red Hermanos Aliados con Enfermedades Raras en Latinoamérica (HACER.LA). Se ha unido como miembro pleno a la Alianza Internacional de Organizaciones de Pacientes (IAPO) como también a la Red Rare Diseases Internacional (RDI). Posee lazos estrechos con EURORDIS, Rare Commons y Rare Connect, entre otros.
Los interesados pueden contactarse a través del sitio web de FADEPOF www.fadepof.org.ar, por la página de Facebook https://www.facebook.com/fadepof o por e-mail a info@fadepof.org.ar


